Dihidroceramida
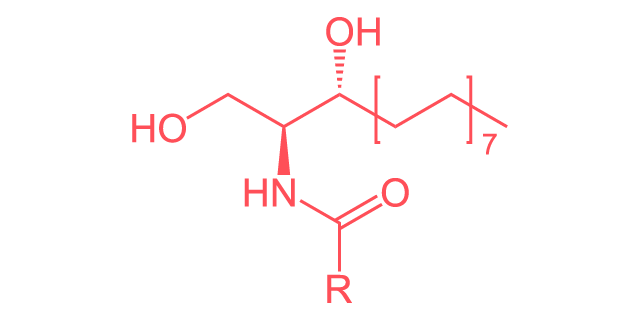
Fórmula lineal
C19H39NO3
Sinónimos
DHC, DCER, DhCer
Compartir este metabolito
Las dihidroceramidas son un grupo de moléculas que contienen un esqueleto de esfingosina y una cadena de acilo graso de diversas longitudes potenciales. Son los precursores de las ceramidas, moléculas centrales en el metabolismo de los esfingolípidos. Como moléculas anfipáticas, las dihidroceramidas tienen propiedades tanto hidrofóbicas como hidrofílicas y son componentes de la membrana plasmática. Junto con los complejos proteínicos de membrana que regulan su síntesis, las dihidroceramidas desempeñan diversas funciones en las respuestas celulares al estrés, la proliferación y la muerte celular, así como en diversas enfermedades.
Dihidroceramida, ceramida sintasa y metabolismo de los esfingolípidos
La síntesis de ceramida de novo comienza en el retículo endoplásmico, donde el aminoácido L-serina y la palmitoil-CoA se convierten en dihidroceramida a través de una cadena de reacciones. El paso final de la vía de síntesis de novo es la unión de uno de los diversos ácidos grasos a la esfinganina por la (dihidro)ceramida sintasa (CerS) para producir dihidroceramida1. Seis enzimas CerS diferentes pueden catalizar la reducción de dihidroceramida a ceramida, dependiendo de la longitud de la cadena de ácidos grasos unida a la esfinganina. Cada enzima presenta especificidad tisular; por ejemplo, CerS2 muestra los mayores niveles de expresión global en todos los tejidos, mientras que CerS1 está presente sobre todo en el cerebro, el músculo esquelético y los testículos2.
Una vez producida la dihidroceramida, puede ser reducida a ceramida por la enzima dihidroceramida desaturasa (DES), lo que da lugar a una reserva de ceramidas disponibles para la biosíntesis de novo de esfingolípidos en el aparato de Golgi. Existen dos enzimas DES, cada una con una especificidad tisular distinta. En particular, la DES1, que se expresa en la mayoría de los tejidos, también funciona como sensor de oxígeno, por lo que desempeña un papel en la gestión de la hipoxia sistémica3.
Dihidroceramidas e integridad de la membrana plasmática
Las dihidroceramidas desempeñan un papel importante en la integridad de las membranas celulares. Las membranas celulares que contienen ceramida son más fluidas que las que contienen dihidroceramidas, ya que un doble enlace adicional afecta a su elasticidad y capacidad de empaquetamiento. Además, las moléculas de ceramida pueden apilarse unas sobre otras de forma antiparalela, formando estructuras en forma de barril. Estos canales pueden llenarse de agua y perforar la membrana mitocondrial, con la consiguiente fuga de proteínas mitocondriales y pérdida de la integridad de la membrana4. Por el contrario, las dihidroceramidas no forman tales canales de membrana e incluso dificultan su formación. Además, los niveles alterados de dihidroceramidas cambian la composición de los lípidos de membrana de los orgánulos, lo que provoca respuestas a nivel celular y tisular.
Dihidroceramidas, estrés oxidativo y muerte celular apoptótica
La hipoxia sistémica y el estrés oxidativo inhiben el DES1, provocando la acumulación de dihidroceramida en las células. Se cree que esta acumulación inhibe la progresión del ciclo celular como parte de la respuesta general a la hipoxia5. La acumulación de dihidroceramida no sólo inhibe la progresión del ciclo celular, sino que también inhibe el crecimiento celular, afectando a las tasas de división celular y conduciendo potencialmente a la detención del ciclo celular como parte de la respuesta celular al estrés oxidativo. Además, cuando las células sufren estrés, los niveles de ceramida aumentan y la relación ceramida-dihidroceramida cambia6. La perforación resultante de la membrana externa mitocondrial debido a los canales de ceramida permite la liberación de proteínas proapoptóticas, como el citocromo c y la adenilato quinasa, al citosol. Junto con la proteína quinasa C y la señalización del factor de necrosis tumoral alfa, esto desencadena de forma abrupta e irreversible la muerte celular apoptótica, un proceso implicado en la fisiología normal pero también en diversos procesos patológicos4.
Dihidroceramidas y enfermedad
Varios estados patológicos, como la inflamación, la tumorigénesis y la progresión de las células cancerosas y el crecimiento tumoral, van acompañados de hipoxia sistémica y estrés oxidativo. Esto ha dado lugar a un creciente número de investigaciones sobre las conexiones entre las dihidroceramidas y las enfermedades, en particular su papel en la promoción de la autofagia citotóxica en las células cancerosas y la inhibición del crecimiento tumoral. Por ejemplo, los estudios han demostrado que las dihidroceramidas, a través de su regulación de las especies reactivas del oxígeno y el metabolismo lipídico, influyen en la secreción y producción de β-amiloide en la enfermedad de Alzheimer3. Además, las dihidroceramidas intervienen en la modulación de las respuestas inmunitarias, vinculando el estrés celular a la inflamación y la regulación de la inflamación inducida por citocinas.
Dihidroceramidas y células cancerosas
La capacidad de las dihidroceramidas para promover la detención del ciclo celular es relevante en la investigación del cáncer, en particular en pacientes con cáncer de mama7. Uno de los posibles focos de atención son las CerS, ya que sus expresiones dependen del tipo, estadio y grado del tumor de mama y las especies de ceramidas resultantes tienen efectos tanto positivos como negativos en el crecimiento tumoral2. Además, estudios preliminares demostraron que el tratamiento de células de glioma con un inhibidor de la esfingosina quinasa, así como de células de carcinoma escamoso de cabeza y cuello humano con terapia fotodinámica, conducía a niveles elevados de dihidroceramida que inhibían el crecimiento celular3. Del mismo modo, la inhibición del DES en células de neuroblastoma humano impide la desaturación de la dihidroceramida. Las dihidroceramidas acumuladas promueven posteriormente la autofagia citotóxica, lo que convierte al DES en otra diana potencial para tratar las células cancerosas8.
Enfermedades cardiometabólicas
En el contexto de las enfermedades cardiometabólicas, el deterioro de la señalización de la insulina debido a la alteración de los niveles de dihidroceramida se ha relacionado con la resistencia a la insulina, lo que complica aún más el tratamiento de la diabetes y las complicaciones cardiovasculares de la obesidad. Los estudios de investigación han descubierto que las cuatro especies de dihidroceramida 18:0, 20:0, 22:0, 24:1 están asociadas con el perímetro de la cintura, un marcador de la acumulación de lípidos y la obesidad8. El aumento de los niveles de dihidroceramidas 18:0, 20:0, 22:0, 23:0 y 24:0 también ha demostrado ser un factor predictivo de la sensibilidad a la insulina y de la aparición de diabetes de tipo 23. Estudios en roedores demostraron además que la inhibición de las DES en los adipocitos provoca estrés oxidativo, muerte celular y acumulación de dihidroceramidas y lípidos, lo que perjudica la diferenciación y la función de los adipocitos9. Sin embargo, no se conocen bien sus funciones en la inducción de la resistencia a la insulina, la sensibilidad a la insulina y la hipertensión.
Enfermedades infecciosas
Como parte integrante de las membranas lipídicas, las dihidroceramidas desempeñan funciones importantes en los procesos de infección vírica y bacteriana. La inhibición farmacológica de DES1 provoca la acumulación de dihidroceramidas y su conversión en dihidroesfingomielina. Esta molécula rigidiza la membrana celular, y las investigaciones han demostrado que esto impide la integración de un péptido de acoplamiento del VIH-1, bloqueando la infección por el VIH-110.
Varias especies de bacterias orales, como Porphyromonas gingivalis, Bacteroides spp, Parabacteroides spp, Tannerella spp y Prevotella spp, producen dihidroceramidas libres y fosforiladas, como las dihidroceramidas fosfoetanolamina y fosfoglicerol. Estos esfingolípidos desempeñan un papel importante en la resistencia bacteriana a las especies oxidativas reactivas y en la progresión de la enfermedad. Por ejemplo, se ha demostrado que las dihidroceramidas fosforiladas penetran en los osteoclastos y potencian la osteoclastogénesis, lo que desencadena la descomposición del tejido gingival y óseo y favorece la periodontitis11.
La dihidroceramida en la investigación
En abril de 2024, había más de 960 citas para "dihidroceramida" y 860 citas para "síntesis de dihidroceramida" en publicaciones de investigación (excluidos libros y documentos) en Pubmed. Varias publicaciones de investigación de los últimos años han relacionado este metabolito con una amplia gama de funciones fisiológicas, muchas de las cuales se discuten aquí. Por lo tanto, cualquier programa de investigación que busque comprender mejor la salud metabólica y neurológica, así como los mecanismos moleculares subyacentes de la tumorigénesis y la muerte celular programada, puede beneficiarse del análisis cuantitativo de este metabolito.
Referencias
- Biblioteca Nacional de Medicina, Centro Nacional de Información Biotecnológica. Resumen de compuestos PubChem, N,N-dimetilarginina (CID 743123831). https://pubchem.ncbi.nlm.nih.gov/compound/123831
- Schnabel R, Blankenberg S, Lubos E, et al. Asymmetric dimethylarginine and the risk of cardiovascular events and death in patients with coronary artery disease: results from the AtheroGene Study. Circ Res. 2005;97(5). doi:10.1161/01.RES.0000181286.44222.61
- Leone A, Moncada S, Vallance P, et al. Accumulation of an endogenous inhibitor of nitric oxide synthesis in chronic renal failure. Lancet. 1992;339(8793):572-575. doi:10.1016/0140-6736(92)90865-Z
- Achan V, Broadhead M, Malaki M, et al. Asymmetric dimethylarginine causes hypertension and cardiac dysfunction in humans and is actively metabolized by dimethylarginine dimethylaminohydrolase. Arterioscle Thromb Vasc Biol. 2003;23(8):1455-1459. doi:10.1161/01.ATV.0000081742.92006.59
- Zoccali C, Benedetto FA, Maas R, et al. Asymmetric dimethylarginine, C-reactive protein, and carotid intima-media thickness in end-stage renal disease. J Am Soc Nephrol. 2002;13(2):490-496. doi:10.1681/ASN.V132490
- Wells SM, Buford MC, Migliaccio CT, et al. La dimetilarginina asimétrica elevada altera la función pulmonar e induce la deposición de colágeno en ratones. Am J Respir Cell Mol Biol. 2009;40(2):179. doi:10.1165/RCMB.2008-0148OC
- Vögeli A, Ottiger M, Meier MA, et al. Asymmetric Dimethylarginine Predicts Long-Term Outcome in Patients with Acute Exacerbation of Chronic Obstructive Pulmonary Disease. Lung. 2017;195(6):717-727. doi:10.1007/S00408-017-0047-9
- Wu Y, Shen S, Chen J, et al. Metabolite asymmetric dimethylarginine (ADMA) functions as a destabilization enhancer of SOX9 mediated by DDAH1 in osteoarthritis. Sci Adv. 2023;9(6). doi:10.1126/SCIADV.ADE5584
- Singh I, Kim J, Saxena N, et al. Función vascular e inmunopatológica de la dimetilarginina asimétrica (ADMA) en la encefalomielitis autoinmune experimental. Immunology. 2021;164(3):602-616. doi:10.1111/IMM.13396
- Mortensen KM, Itenov TS, Hansen MB, et al. Mortality in critical illness: The impact of asymmetric dimethylarginine on survival-A systematic review and meta-analysis. Acta Anaesthesiol Scand. 2019;63(6):708-719. doi:10.1111/AAS.13339
- Aggarwal S, Gross CM, Kumar S, et al. Dimethylarginine dimethylaminohydrolase II overexpression attenuates LPS-mediated lung leak in acute lung injury. Am J Respir Cell Mol Biol. 2014;50(3):614-625. doi:10.1165/RCMB.2013-0193OC
- Sozio E, Hannemann J, Fabris M, et al. The role of asymmetric dimethylarginine (ADMA) in COVID-19: association with respiratory failure and predictive role for outcome. Sci Rep. 2023;13(1):1-10. doi:10.1038/s41598-023-36954-z

